Acción Galvánica. Cosas básicas respecto a la corrosión
Qué es la corrosión?
La corrosión es un proceso electroquímico de deterioro de los componentes de los metales cuando se encuentran en medios acuosos. Ocurre tanto bajo el agua como en la superficie.
El deterioro es el proceso de oxidación de los metales. El acero, por ejemplo, se degradara otra vez a su estado natural.
El mecanismo de la corrosión
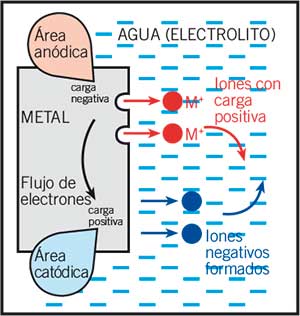
Los átomos de la superficie del metal liberan los electrones y estos pasan a ser iones con carga positiva, que se disuelven en el agua o electrolito (liquido que puede conducir electricidad). Los electrones fluyen en el metal desde las áreas de corrosión hasta otras áreas donde forman iones negativos.
Los iones positivos fluyen en el agua y se combinan con los iones negativos fluyendo en dirección contraria.
Entonces puedes ver que una corriente eléctrica se forma entre ciertas áreas de la superficie del metal, dando como resultado una pérdida de metal (corrosión) en las áreas anódicas. En las áreas catódicas, solo los electrones son perdidos por lo tanto aquí no hay perdida de metal, de hecho está protegida.
Corrosión Galvánica
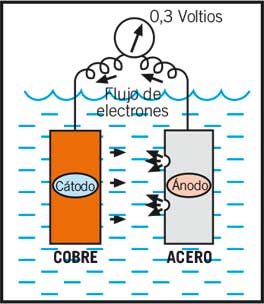
Cuando dos metales distintos (cobre y acero por ejemplo) están en contacto los electrones fluirán desde el más cargado negativamente (ánodo) al más cargado positivamente (cátodo). El voltaje creado entre el cobre y el acero sería de 0.3 voltios. El circuito es completado por la pérdida de iones positivos que van desde el ánodo hacia el electrolito, y por los iones negativos del cátodo que también irán al electrolito.
Esta emisión de pequeñas partículas (iones) al agua es mucho más rápida que cuando nos encontramos con un solo metal, y únicamente provoca corrosión en el ánodo (acero). El material catódico (cobre) está protegido.
Ánodo de sacrificio
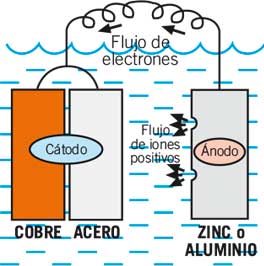
Si tu quieres proteger los dos metales tienes que añadir un tercer metal más activo. El más común es el zinc aunque también se usan el magnesio y el aluminio. Este metal activo se convierte en el ánodo para los dos otros metales.
El zinc o el aluminio se sacrifican para proteger a los otros dos metales, y de aquí viene el término ánodo de sacrificio.
Porque unos metales se corroen más que otros?
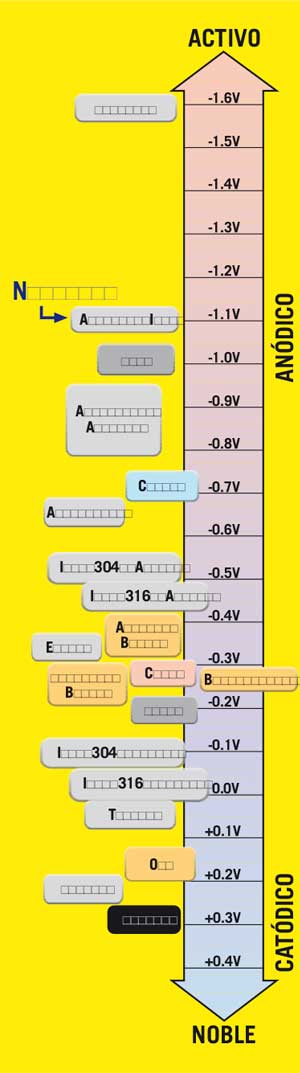
Todos los metales tienden a oxidarse (corroerse), algunos más fácilmente que otros. La tasa relativa se puede ver en las series galvánicas-
Qué factores afectan a la corrosión?
Nota: Algunos de estos factores pueden variar microscópicamente en la superficie del metal.
Conductividad del electrolito - el agua salada es un buen conductor de la electricidad y el agua dulce es un mal conductor, debido a esto la corrosión será mayor en agua salada
Cantidad de oxigeno – por regla general, las tasa de corrosión aumentan en proporción a la cantidad de oxigeno que hay en el agua.
De todas formas, las grietas y hendiduras, que son áreas privadas de oxigeno, se convierten en anódicas y también se corroen.
Presencia de contaminantes - aumenta la corrosión
Caudal - aumenta la tasa de corrosión. Sin embargo, la corrosión en picaduras del acero inoxidable se ve reducida.
Temperatura- las altas temperaturas aumentan el índice de corrosiónaproximadamente se duplica cada 10ºC.
Tensión - metales bajo tensión de tracción en combinación con corrosión pueden sufrir un fallo repentino debido a una fisura.
Presencia de organismos biológicos - hay varios tipos de microorganismos que pueden contribuir a la corrosión, tanto por remover la protección como por la creación de medios corrosivos.
Área y peso de ánodos
El área de la superficie de los ánodos de sacrificio determina cuanta protección (amperaje) se obtiene. El peso determina cuanto tiempo
duraran. Distintos ánodos tienen distintas capacidades medidas en Amperios Hora por Libra.
Relación del cátodo y el ánodo
El ratio entre el área de la superficie catódica y la superficie anódica es crítica en la corrosión galvánica. Cuanto más pequeña sea el área en la cual el ánodo está liberando materia, más rápida será aquella. En una situación ideal el área del ánodo debería ser mucho más grande que el área del cátodo. Esta relación se ve mejorada cuando pintamos la superficie catódica. Nunca pinte la superficie del ánodo.
ÁNODOS, QUÉ HACER Y QUÉ NO HACER
Qué hacer:
• Cambie sus ánodos cuando ellos estén al 50%. Un “indicador de desgaste” en el ánodo te ayudará a saber cuándo hay que cambiarlo.
• Asegúrese de que hace un buen contacto eléctrico, saque la pintura y limpie la superficie de montaje.
• Proteja las chapas de los flaps individualmente (no los conexione). Aunque están fabricados normalmente de acero inoxidable pueden afectarle la corrosión y necesitan ánodos de sacrificio.
• En los fuerabordas y dentrofuerabordas asegúrese de usar tornillos de fijación nuevos (normalmente suministrados con el ánodo). Incluso los tornillos de acero inoxidable pueden fallar como consecuencia de la corrosión.
• Mantenga las colas sumergidas para que los ánodos puedan trabajar.
Qué no hacer:
• No pintar los ánodos. No trabajarán.
• No mezclar diferentes tipos de ánodos. Los ánodos de aluminio protegerán los ánodos de zinc en un mismo circuito conexionado.
• No usar ánodos de zinc en fuerabordas y colas de aluminio. No proporcionan la protección adecuada.
• No usar ánodos de magnesio en fuerabordas y colas cuando están en aguas saladas o salobres ya que éstos “sobreprotegerán” el aluminio.
Corrosión galvánica por vía de la toma de tierra
La conexión a la toma de puerto pone en conexión tu masa con la de los barcos que están a tu alrededor. Si ellos no están protegidos con los ánodos adecuados, tú los estarás protegiendo con tus ánodos, causando un rápido desgaste de los mismos.
Aislador galvánico
El aislador galvánico es un aparato que se instala en el cable de masa de la toma de puerto con el fin de bloquear las corrientes galvánicas directas, permitiendo el paso de la corriente alterna (AC). ATENCION: Asegurarse de que el aislador galvánico tiene una capacidad
ajustada al consumo que se tiene (30A ó 50A). Los aisladores galvánicos de escasa calidad han sido causa de incendios, por ello es importante instalar uno que sea aprobado por el ABYC o por UL para asegurarse de su calidad y funcionamiento.
Corrosión (electrolítica) por corrientes errantes
Esta es una corrosión causada por una corriente perdida que fluye de una batería o de otra fuente de corriente continua (DC). Esta corriente fluye desde el metal hacia el agua causando en el proceso pérdida de material o corrosión. Las causas más comunes incluyen un cable pelado en la sentina o equipos instalados o cableados incorrectamente.
Sistema de corriente impresa
En lugar de usar un ánodo de sacrificio para generar una corriente de protección, también puede usarse una fuente eléctrica de corriente continua (DC).
El principio es el mismo pero la corriente es ajustada y monitorizada por el sistema. Un material no corrosivo es usado como ánodo.
La ventaja de un sistema de corriente impresa es que puede generar voltajes más altos que un ánodo de sacrificio. La desventaja es
que este sistema puede “sobreproteger”. Los sistemas de corriente impresa pueden ser usados por cualquier tipo de barco cualquiera
que sea su sistema de propulsión.
Conexión
Todos los equipos eléctricos y los metales en contacto con el agua deben de estar conectados al mismo punto de masa (conectado con el terminal negativo de la batería). Esto va a asegurar que todos los componentes tengan el mismo voltaje, previniendo de la existencia de corrientes errantes.
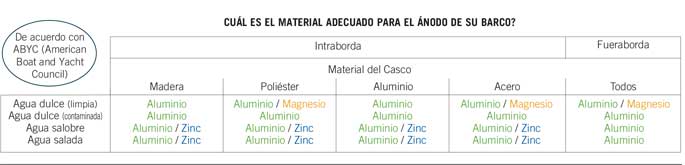
Materiales de los ánodos de sacrificio
Ánodos de zinc
Zinc es el material más usado. Los ánodos de zinc no son eficaces en agua dulce y pueden dejar de trabajar después de pocos meses si no se han fabricado de acuerdo con la norma Mil. Spec. Es una buena práctica cambiarlos regularmente, incluso si parecen en buen estado. Recuerde, si un ánodo no está perdiendo material, no está trabajando. Los ánodos MGDUFF están fabricados con una aleación de zinc conforme a US MIL Spec-18001K.
Ánodos de aluminio NavalloyTM
La aleación de aluminio usada en los ánodos de Navalloy es muy diferente del aluminio normal. Esta aleación incluye cerca de un 5% de zinc y una pequeña cantidad de Indio, lo cual previene de la aparición de una capa de oxido. Navalloy es una aleación conforme a las especificaciones militares US MIL Spec-A-24779.
Los ánodos de aleación de aluminio ofrecen mayor protección y duran más que los de zinc (ver la tabla). Trabajan tanto en agua dulce como en agua salada. Los ánodos de aluminio son los únicos ánodos que ofrecen protección en toda clase de aplicaciones.
Ánodos de Magnesio
El magnesio es el metal más activo en la escala Galvánica. Puede ser usado en agua dulce, pero habrá que tener cuidado. El magnesio puede sobreproteger los cascos de aluminio y los fuerabordas o las colas en aguas saladas, salobres o incluso en agua dulce contaminada, originando que la pintura se levante como resultado de la corrosión. Solo con unas pocas horas de inmersión pueden originarse severos daños.
Algunos datos sobre los metales más comunes en el mar
Aluminio – Es un excelente material para el uso marino (Grado marino: 5000 ó 6000). El aluminio es robusto, ligero y fácil de trabajar. Tiene una excelente resistencia a la corrosión, debido a su habilidad para formar rápidamente un film protector de oxido en la superficie. Si está desprotegido, pueden aparecer pequeños agujeros o cubierto con un polvo arenoso blanco, si bien esto es normalmente superficial y no dañino. Al protegerlo con un ánodo desaparecerá esto.
Es, sin embargo, muy activo en la escala galvánica (-0,76 a -1,00 voltios), lo cual lo hace propenso a la corrosión cuando está en contacto con metales más nobles. Los herrajes de Bronce, Latón o Monel deben de evitarse o aislarse para prevenir la acción galvánica. Se recomiendan herrajes de acero inox (316). El Aluminio puede llegar a sobreprotegerse por demasiado voltaje de los ánodos de magnesio en agua salada, salobre o dulce contaminada.
Latón – Es una aleación de cobre y zinc. Generalmente no recomendable en áreas expuestas. El latón sufre la perdida de zinc, como consecuencia de la corrosión galvánica de la aleación, dejando un material esponjoso y frágil. Necesita protección galvánica cuando se usa dentro del agua.
Bronce – Son aleaciones del cobre con poco o sin zinc. Los auténticos bronces son robustos y extremadamente resistentes a la corrosión tanto atmosférica como cuando está sumergido. Los bronces pueden contener estaño, aluminio, níquel o fosforo, pero el mejor y más ampliamente usado es el bronce silicio. Usado normalmente en herrajes y elementos de sujeción.
Acero inoxidable – Material muy usado con una gran resistencia a la corrosión.
El acero inoxidable debe su resistencia a la corrosión a su contenido en Cromo, el cual forma un film de oxido que lo hace resistente a los ataques (se habla entonces de pasivado). El contenido en Níquel mejora las propiedades de soldadura. 18/8 (% de Cromo y de Níquel) es el de menor grado (inox 304). Es mejor el inox 316, que incorpora Molibdeno, y mejora la resistencia a la corrosión.
Si el inox está en ausencia de oxigeno (ej.: debajo de una junta o de las incrustaciones) pierde el film de oxido protector y se convierte en activo. Entonces se corroerá rápidamente. Esto puede ocurrir también en las grietas microscópicas resultando una corrosión casi invisible que puede originar fallos en el material. Es muy adecuado para herrajes en la cubierta y no se recomienda para su uso dentro del agua (excepto cuando esta galvánicamente protegido como, por ejemplo los tornillos en un fueraborda).
Cascos de madera – Muy propensos al deterioro debido a los diversos tipos de pudrición de la madera y a la corrosión acusada por accesorios de metal y elementos de fijación. Se recomienda la instalación de herrajes de Bronce
Silicio. No usar acero inox debajo de la línea de flotación. Cascos de poliéster reforzado con fibra de vidrio – Se recomienda usar
herrajes de Bronce Silicio debajo de la línea de flotación.
ATENCION: Las fibras de carbono (grafito) son conductores eléctricos y pueden causar corrosión galvánica entre componentes metálicos de la estructura